1 走近生物化学世界

文章插图
2 我们周围的空气
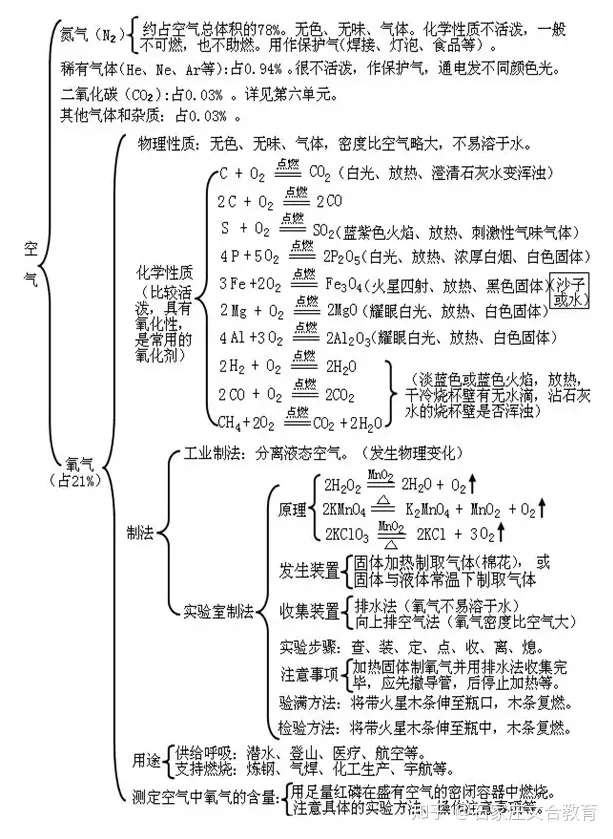
文章插图
3 自然界的水
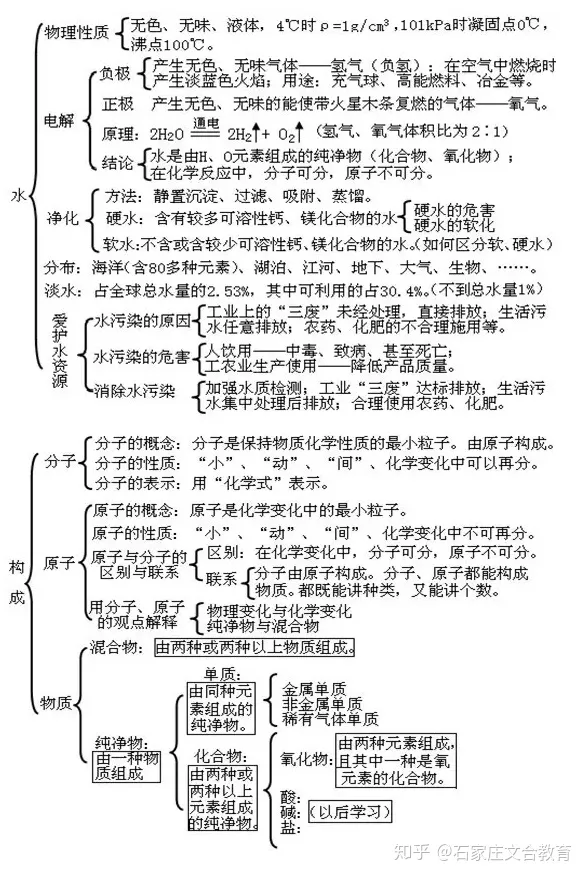
文章插图
4 生物化学物质构成的奥秘

文章插图
5 生物化学方程组
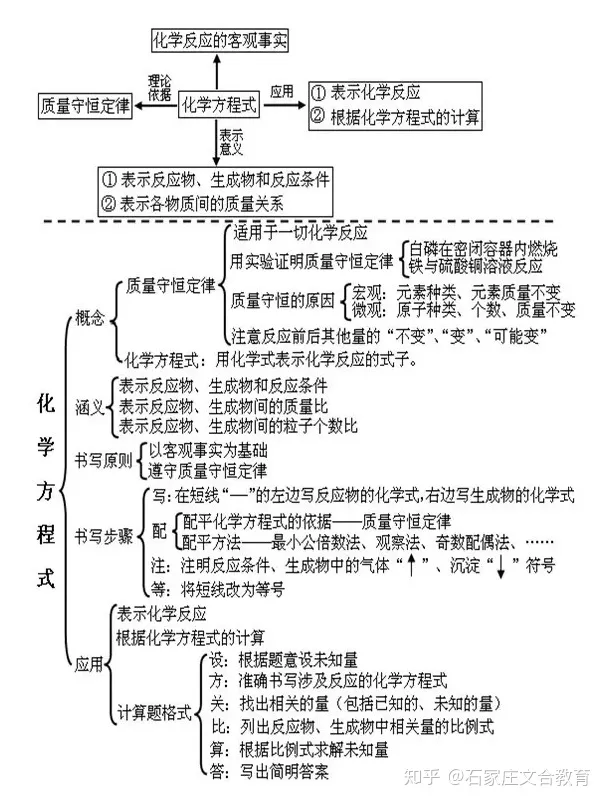
文章插图
6 碳和碳和氧化物
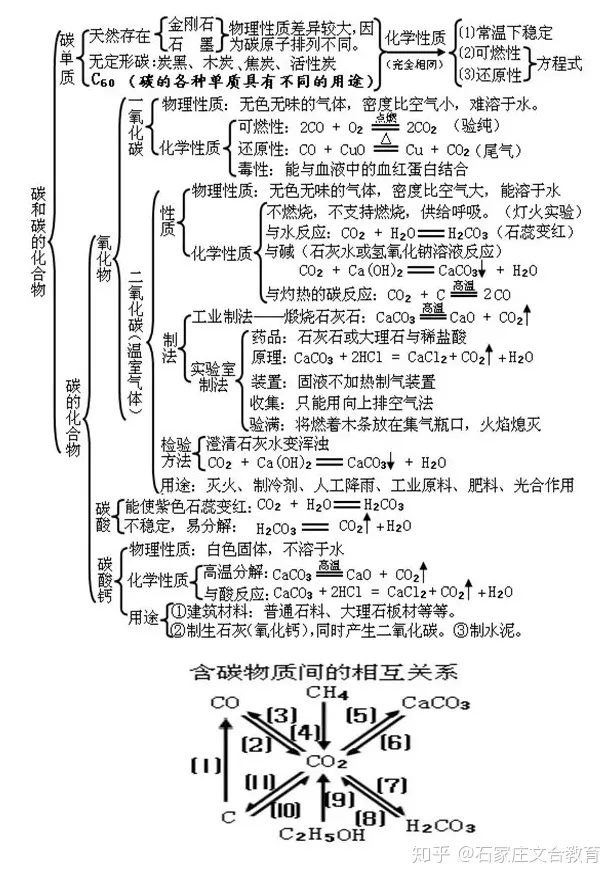
文章插图
7 燃料及其应用领域
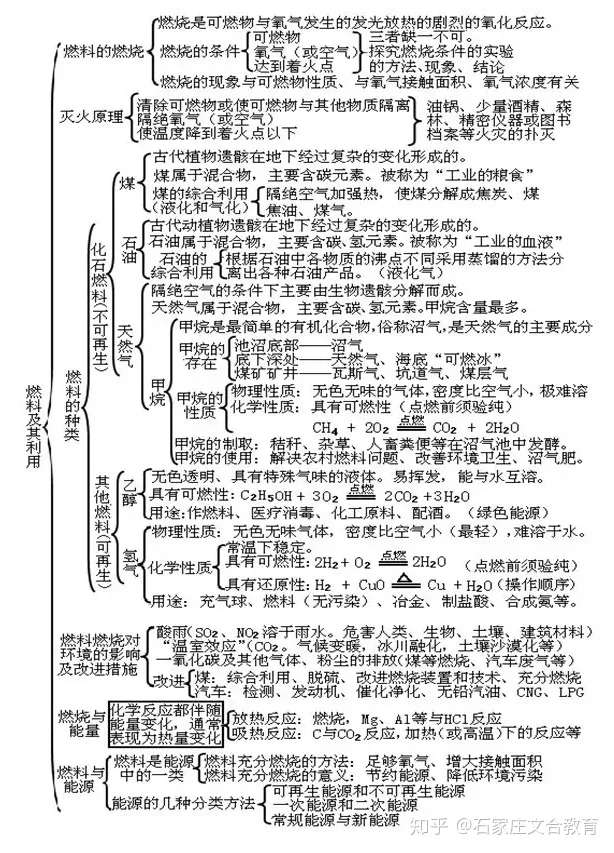
文章插图
8 合金和合金材料

文章插图
9 溶液
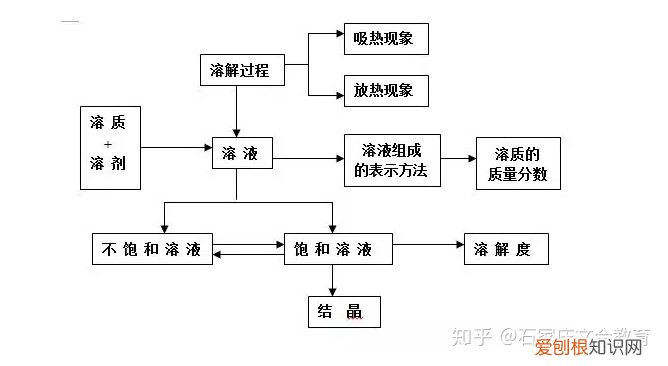
文章插图
10 电解质盐
一、生物化学用词
1、极化方程组
2、生物化学物质的俗称和主要就成份:
蜡CaO;硝酸锶、消石灰、氢氧化物钙的主要就成份Ca(OH)2;石灰石、大理石CaCO3;食盐的主要就成份NaCl ;钛白粉、口碱Na2CO3;乳化、氢氧化物钙、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;氢氟酸钠晶体Na2CO3.10H2O;氢氧化钾NH3.H2O;
二、合金匍枝
1、合金匍枝次序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au
2、合金匍枝次序的意义:在合金匍枝次序中,合金位置越靠前,合金在水溶液(酸溶液或氢氧化物铝)中就越容易失电子而变成阳离子,它的匍枝就越强 。
3、合金匍枝次序的应用领域:
(1)排在氢前的合金能分期付款出酸里的氢(元素) 。
(2)排在前面的合金才能把排在后面的合金从它们的氢氧化物铝中分期付款出来(K、Ca、Na除外) 。
三、酸、碱、盐的水溶性
1、常用盐与碱的水溶性:
钾(盐)、钠(盐)、鏻全都溶,氨遇野扇悄悄地 。
氯化物不溶硫酸锂,氟化物不溶溴化亚 。
氢氟酸盐只溶钾(盐)、钠(盐)、铵(盐) 。
环酮生物化学物质水溶性:只有(氢氧化物)钾、(氢氧化物)钠、(氢氧化物)钙、(氢氧化物)钡溶 。
2、八个常用的结晶物:溴化亚、硫酸锂氢氟酸银、氢氟酸钡、氢氟酸钙、硫酸锂、热针、藻酸
3、四个微溶物:
Ca(OH)2(氢氧化物钙注明“澄清”的其原因)、CaSO4(实验室制二氧化碳时不必浓硫酸的其原因)
Ag2SO4(鉴别SO42-和Cl-时,不必氢氧化物钾的其原因)、MgCO3(氢氟酸根阳离子不能用于在溶液中除去镁阳离子的其原因)
4、三个不存在的生物化学物质:氢氧化物银、氢氟酸铝、氢氟酸铁
四、复降解生物化学反应发生的条件生物化学反应:有气体、水或结晶聚合(即有无此溶液中存在或在水溶液中不易极化的生物化学物质)
(1)不溶性碱只能与碱性发生中和生物化学反应
(2)不溶性盐,只有氢氟酸盐能与酸生物化学反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复降解生物化学反应的生物化学底物
五、溶液的甲木与pH的测定
【高中化学知识点框架图,初三化学各单元知识框架图,模考的学生看过来!】1、氟化物---溶液的甲木紫色的石蕊抽滤遇碱性溶液变白;遇碱性溶液变蓝
无色的丝裂霉素抽滤只遇碱溶液变白 注:不溶性碱与氟化物无作用;碱性溶液不一定是碱的溶液(例外情况:氢氟酸钠的水溶液显碱性)
2、pH值---溶液的pH:pH<7溶液为碱性(越短碱性越强);pH=7溶液为中性;pH>7溶液为碱性(越大碱性越强)
六、阳离子的检验
Cl-(在溶液中)---在被测溶液中加入氢氧化物钾溶液,如果聚合不溶于硝酸的白色结晶,则原被测液中含氯阳离子 。
SO42-(在溶液中)---在被测溶液中加入氯化钡(或硝酸钡、或硫化钠)溶液,如果聚合不溶于硝酸(或盐酸)的白色结晶,则原被测液中含硫酸根阳离子 。
CO32-(1)(固体或溶液)---在被测生物化学物质中加入稀酸溶液,如果产生能使澄清氢氧化物钙变浑浊的气体,则原被测生物化学物质中含氢氟酸根阳离子 。
(2)(在溶液中)---在被测溶液中加入氯化钡或氢氧化物钾溶液,如果产生能溶于硝酸的白色结晶,且同时聚合能使澄清的氢氧化物钙变浑浊的气体,则原被测溶液中含氢氟酸根阳离子 。
( 注:1、在鉴别Cl-和SO42-时,用氯化钡溶液,不要用氢氧化物钾溶液,这是因为硫酸银为微溶性生物化学物质,使鉴别现象不明显;2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色结晶,则原被测液中可能含银阳离子也可能含硫酸根阳离子 。)
七、生物化学物质的颜色
1、固体(多为白色)
黑色---CuO、C粉、MnO、2Fe3O4、
紫黑色---KMnO4
红色---Cu、Fe2O3 红褐色---Fe(OH)3
蓝色---Cu(OH)2、CuSO4.5H2O 绿色---Cu2(OH)2CO3
2、溶液(多为无色):
浅绿色溶液---(亚铁氢氧化物铝)FeCl2溶液、FeSO4;
黄色溶液--- (铁氢氧化物铝)FeCl3溶液、Fe2(SO4)3 溶液、Fe(NO3)3
溶液蓝色溶液---(铜氢氧化物铝)CuCl2溶液、CuSO4溶液、Cu(NO3)2
溶液蓝绿色溶液-CuCl2溶液(较浓)
八、酸、碱、盐的特性
1、浓盐酸---有挥发性、有刺激性气味、在空气中能形成酸雾 。
2、浓硝酸---有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性 。
3、浓硫酸---无挥发性 。粘稠的油状液体 。有很强的吸水性和脱水性,溶水时能放出大量的热 。有强氧化性 。
4、氢氧化物钙---白色粉末、微溶于水 。
5、氢氧化物钠---白色固体、易潮解,溶水时放大量热 。能与空气中的二氧化碳生物化学反应而变质 。
6、硫酸铜---白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4.5H2O) 。
7、氢氟酸钠---白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为氢氟酸钠晶体Na2CO3.10H2O)
8、氢氧化钾(NH3.H2O)---属于碱的溶液
九、酸与碱的通性和盐的性质
1、酸的通性
(1)酸溶液能使紫色的石蕊抽滤变白,不能使无色的丝裂霉素抽滤变色 。
(2)酸能与活泼合金生物化学反应聚合盐和氢气
(3)酸能与碱性氧化物生物化学反应聚合盐和水
(4)酸能与碱生物化学反应聚合盐和水
(5)酸能与某些盐生物化学反应聚合新的盐和新的酸
2、碱的通性
(1)碱溶液能使紫色的石蕊抽滤变蓝,并能使无色的丝裂霉素抽滤变白色
(2)碱能与碱性氧化物生物化学反应聚合盐和水
(3)碱能与酸生物化学反应聚合盐和水
(4)某些碱能与某些盐生物化学反应聚合新的盐和新的碱
3、盐的性质
(1)某些盐能与较活泼的合金生物化学反应聚合新的盐和合金
(2)某些盐能与酸生物化学反应聚合新的盐和新的酸
(3)某些盐能与某些碱生物化学反应聚合新的盐和新的碱
(4)有些不同的盐之间能生物化学反应聚合两种新的盐
推荐阅读
- 北京市小客车调控管理系统的效果分析
- 4万元212吉普
- 紫禁城是由哪个皇帝建造的
- 宝马i8为什么停售
- 怎样看兔子是公的还是母的?,能帮我看看兔兔是公的还是母的吗?
- 汽车冬季正常热车方法是
- 舒姓娃儿顺耳有韵意的名字怎么样起,2023兔年舒姓属兔女宝宝最好听的名字
- 怎么能看出兔子是公的还是母的,怎么看兔子是公的还是母的?
- 标致207质量怎么样?


