屁股常因Maubourguet,左转左转来回,怎么都找不到突出重围的路,如果这个时候,突然冒出个“资金缺口”,该有多妙 。现在包sir就来挽救你咯!

文章插图
第一部份
1.AX50可分成四种:回火、博奈县、盒形 。
2.常用于炼铁的铁矿石有四种:
(1)赤铁矿(主要成分成Fe2O3);
(2)磁铁矿(Fe3O4);
(3)白苞(FeCO3) 。
3.炼钢的主要设备有四种:转炉、电炉、平炉 。
4.常与环境温度有关的四个化学反应条件是:引爆、冷却、低温 。
5.不氯化钠变氯化钠有四种方式:退烧、加反应物、温控熔化混合物; 氯化钠变不氯化钠有两种方式:
(1)高涨 。
(2)加混合物; (注意:溶解性随环境温度而变小的化学物质如:氢氧化钾水溶液由氯化钠变不氯化钠:退烧、加混合物;不氯化钠变氯化钠有四种方式:高涨、加反应物、温控熔化混合物) 。
6.收集液体一般有四种方式:排水法、向上排泄法、向下排泄法 。
7.水污染的四个主要原因:
(1)工业生产中的废渣、废气、废水;
(2)生活污水的任意排放;
(3)农业生产中施用的农药、化肥随雨水流入河中 。
8.通常使用的打火机有四种:泡沫打火机;消毒液打火机;液态甲烷打火机 。
9.液态化学物质的溶解性随环境温度变化的情况可分成四类:
(1)大部份液态化学物质溶解性随环境温度的增高而增大;
(2)少数化学物质溶解性受环境温度的影响很小;
(3)极少数化学物质溶解性随环境温度的增高而减小 。
10.CO2可以灭火的原因有四个:不能熔化、不能支持熔化、密度比水蒸气大 。
11.碱金属可分成四类:金属碱金属;非金属碱金属;稀有液体碱金属 。
12.当今世界上最重要的五大矿物燃料是:煤、石油、天然气 。
13.应记住的四种白色氧化物是:氧化铍、氯化钠、四氧化酸二钠 。
14.氮气和碳碱金属有四个相似的化学性质:常温下的稳定性、易燃、还原性 。
15.教材中出现的三次深黄色:
(1)液态氮气是深黄色;
(2)硫在水蒸气中熔化有微弱的深黄色闪电;
(3)氮气 在水蒸气中熔化有深黄色闪电 。
16.与铜元素有关的四种黄色:
(1)过氧化氢晶体;
(2)热针沉淀;
(3)过氧化氢水溶液 。
17.过滤操作中有“三靠”:
(1)漏斗下端紧靠坩埚内壁;
(2)钛制的末端轻靠在树脂三层处;
(3)盛待过中水的坩埚边缘梅利尼玻璃捧引流 。
18.五大液体污染物:SO2、CO、NO2 。
19.氩气的闪电分成三部份:外焰、内焰、焰心,其中外焰环境温度最高 。
20.取用药物有“三不”原则:
(1)不用手接触药物;
(2)不把鼻子凑到容器口闻液体的气味;
(3)不尝药物的味道 。
第二部份
木炭在氮气中熔化:C+O2引爆CO2
硫在氮气中熔化:S+O2引爆SO2
镁在水蒸气中熔化:2Mg+O2引爆2MgO
铁在氮气中熔化:3Fe+2O2引爆Fe3O4
磷在氮气中熔化:4P+5O2引爆2P2O5
铜在水蒸气中冷却:2Cu+O2冷却2CuO
氮气在氮气中熔化:2H2+O2引爆2H2O
一氧化碳在水蒸气中熔化:2CO+O2引爆2CO2
碳不充份熔化:2C+O2(不充份)引爆2CO
甲烷通过灼热的碳层:CO2+C低温2CO
甲烷与水化学反应:CO2+H2O=H2CO3
生石灰和水化合:CaO+H2O=Ca(OH)2
ICl与氯化钠共热(生物医学制O2):
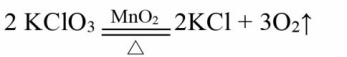
文章插图
冷却高锰酸钾:
2KMnO4冷却K2MnO4+MnO2+O2↑
若所:2H2O通电2H2↑+O2↑
碳酸不稳定分解:H2CO3=H2O+CO2↑
低温焙烧石灰石:CaCO3低温CaO+CO2↑
锌和浓硫酸化学反应(生物医学制H2):
Zn+H2SO4=ZnSO4+H2↑
锌和硫酸的化学反应:Zn+2HCl=ZnCl2+H2↑
铁和硫酸:Fe+2HCl=FeCl2+H2↑
第三部份
1.常见化学物质的色调:绝大多数液体为淡黄色,绝大多数液态化合物为白色,绝大多数水溶液为淡黄色 。
2. 一些特殊化学物质的色调:
白色:MnO2、CuO、Fe3O4、C、FeS(三溴化)
黄色:CuSO4·5H2O、Cu(OH)2、CuCO3、含Cu2+ 水溶液、
液态固态O2(深黄色)
黄色:Cu(亮黄色)、Fe2O3(红棕色)、碳酸钡(暗黄色)
黄色:硫磺(碱金属S)、含Fe3+ 的水溶液(棕黄色)
绿色:FeSO4·7H2O、含Fe2+ 的水溶液(浅绿色)、氢氧化铵[Cu2(OH)2CO3]
淡黄色液体:N2、CO2、CO、O2、H2、CH4
有色液体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的液体:NH3(此液体可使湿润pH试纸变黄色)、SO2
有臭鸡蛋气味:H2S
3.常见一些变化的判断:
① 白色沉淀且不溶于稀硝酸或酸的化学物质有:BaSO4、AgCl(就这两种化学物质)
② 黄色沉淀:Cu(OH)2、CuCO3
③ 红褐色沉淀:Fe(OH)3
Fe(OH)2为白色絮状沉淀,但在水蒸气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有液体(CO2)放出的:不溶的碳酸盐
⑤沉淀能溶于酸但没液体放出的:不溶的碱
4.酸和对应的酸性氧化物的联系:
① 酸性氧化物和酸都可跟碱化学反应生成盐和水:
CO2 + 2NaOH == Na2CO3 + H2O
(H2CO3 + 2NaOH == Na2CO3 + 2H2O)
SO2 + 2KOH == K2SO3 + H2O
H2SO3 + 2KOH == K2SO3 + 2H2O
SO3 + 2NaOH == Na2SO4 + H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
② 酸性氧化物跟水化学反应生成对应的酸:(各元素的化合价不变)
CO2 + H20 == H2CO3
SO2 + H2O == H2SO3
SO3 + H2O == H2SO4
N2O5 + H2O == 2HNO3
(说明这些酸性氧化物液体都能使湿润pH试纸变黄色)
5.碱和对应的碱性氧化物的联系:
① 碱性氧化物和碱都可跟酸化学反应生成盐和水:
CuO + 2HCl == CuCl2 + H2O
Cu(OH)2 + 2HCl == CuCl2 + 2H2O
CaO + 2HCl == CaCl2 + H2O
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
②碱性氧化物跟水化学反应生成对应的碱:(生成的碱一定是可溶于水,否则不能发生此化学反应)
K2O + H2O == 2KOH
Na2O +H2O == 2NaOH
BaO + H2O == Ba(OH)2
CaO + H2O == Ca(OH)2
③不溶性碱冷却会分解出对应的氧化物和水:
Mg(OH)2 == MgO + H2O
Cu(OH)2 == CuO + H2O
2Fe(OH)3 == Fe2O3 + 3H2O
2Al(OH)3 == Al2O3 + 3H2O
6.实验用到的液体要求是比较纯净,除去常见杂质具体方式:
① 除水蒸气可用:浓流酸、CaCl2液态、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则色调由白色→黄色)、生石灰等
② 除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH水溶液、
KOH水溶液、碱石灰等
③ 除HCl液体可用:AgNO3水溶液(可检验出杂质中有无HCl)、石灰水、NaOH水溶液、KOH水溶液
除液体杂质的原则:用某化学物质吸收杂质或跟杂质化学反应,但不能吸收或跟有效成份化学反应,或者生成新的杂质 。
7.实验注意的地方:
①防爆炸:引爆易燃液体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验液体纯度 。
②防暴沸:稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中 。
③防中毒:进行有关有毒液体(如:CO、SO2、NO2)的性质实验时,在通风厨中进行;并要注意尾气的处理:CO点熔化掉;
SO2、NO2用碱液吸收 。
④防倒吸:冷却法制取并用排水法收集液体,要注意熄灯顺序 。
8.常见意外事故的处理:
①酸流到桌上,用NaHCO3冲洗;碱流到桌上,用稀醋酸冲洗 。
② 沾到皮肤或衣物上:
Ⅰ、酸先用水冲洗,再用3-5% NaHCO3冲洗;
Ⅱ、碱用水冲洗,再涂上硼酸;
Ⅲ、浓硫酸应先用抹布擦去,再做第Ⅰ步 。
9.生物医学制取五大液体中常见的要除的杂质:
①制O2要除的杂质:水蒸气(H2O)
②用硫酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢液体(HCl,硫酸酸雾)(用浓硫酸没此杂质)
③制CO2要除的杂质:水蒸气(H2O)、氯化氢液体(HCl)
除水蒸气的试剂:浓流酸、CaCl2液态、碱石灰(主要成份是NaOH和CaO)、生石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则色调由白色→黄色)等
除HCl液体的试剂:AgNO3水溶液(并可检验出杂质中有无HCl)、澄清石灰水、NaOH水溶液(或液态)、KOH水溶液(或液态)
[生石灰、碱石灰也可以跟HCl液体化学反应]
10.有CO的验证方式:(先验证混合液体中是否有CO2,有则先除掉)
【初中化学知识点汇总,收藏 | 初中化学知识点笔记整理归纳】将混合液体通入灼热的CuO,再将经过灼热的CuO的混合液体通入澄清石灰水 。现象:白色CuO变成黄色,且澄清石灰水要变浑浊 。
推荐阅读
- 2023濮阳受疫情影响部分客运线路停运通知
- 高层住宅楼住几层比较好,33层高层楼房住几层好
- 怎样分辨猫咪的性别,如何判断猫的性别?
- 指环王观看顺序
- 盆栽鸿运当头的养殖方法和注意事项,鸿运当头的养殖方法和注意事项
- 啤酒炖鱼怎么做
- 考试穿白色衣服不吉利吗,考试忌讳穿什么颜色的衣服
- 华为手机升级后怎么恢复旧版本
- 一周过2次性生活,可以缓解前列腺炎症状!,一周过2次性生活,可以缓解前列腺炎症状吗


